Concentration = 58,5.10-6 x 176 / 0,02 = 0,515 g.L-1
comprimé de Laroscorbine vaut presque 1L de jus d'orange encore vivantes
... 
C6H8O6 (aq) + I2 (aq) ---> C6H6O6 (aq) + 2H+ +2I-
b) On introduit 20.10-3x5,15.10-3 = 0,103 m.mol de I2
c) Lorsqu'on dose l'excès de diiode par le thiosulfate, on trouve qu'il en reste:
17,8.10-3x5.10-3/2 =44,5.10-6 mol de I2
d) l'oxydation de l'acide ascorbique a consommé 103-44,5 = 58,5.10-6 mol de I2, il y avait donc 58,5.10-6 mol d'acide ascorbique dans les 20 mL de jus d'orange.
Concentration = 58,5.10-6 x 176 / 0,02 = 0,515 g.L-1
comprimé de Laroscorbine vaut presque 1L de jus d'orange encore vivantes
... 
3 dosage de l'acide ascorbique.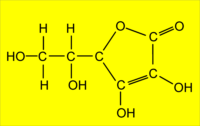 Cette
molécule possède de nombreux sites suceptibles de
Cette
molécule possède de nombreux sites suceptibles de
C6H6O6 (aq) + 2H+ +2e- = C6H8O6 E° = ? (I)
I2 (aq) + 2e- = 2I- E° = 0,61 V
On ignore le potentiel de l'acide ascorbique mais de la façon dont les choses se déroulent il est certain que la réaction (I) évolue vers la gauche. Ces deux réactions se font mole pour mole.