
précipitent . Sous l'anode soluble, un tas de boue se forme, contenant les insolubles et le sulfate de plomb.
d) Quelle est la masse de cuivre contenue dans l'anode brute ?
mCu = 1500 x 0,98 = 1470 g
Il faut 2 mol d'électrons (2 faradays) pour traiter 1 mol de Cu.
Q = 2x F x mCu / MCu = I x Dt
Dt = 452866 s = 125 h 47 min 46 s
Le corrigé dans le livre a encore mélangé deux exercice contigus.
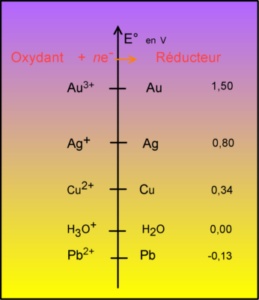
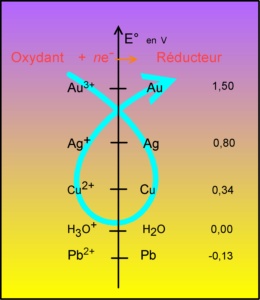
Les éléments Au et Ag ne s'oxydent pas: c'est le Cu qui devient Cu2+
a) A l'anode: oxydation des éléments si leur potentiel normal le leur permet. Les cations passent en solution (si ils sont compatibles aves l'ion sulfate présent partout dans l'électrolyte). Sous l'influence du champ électrique ils migrent vers la cathode. Ils y sont réduits en atomes et se déposent sur la cathode.
b) à la cathode
Cu2+(aq) + 2e- ---> Cu(s)
à l'anode
Cu(s) ---> Cu2+(aq) + 2e-
c) Lorsque Cu se fait oxyder, Pb aussi. Les ions Pb pourraient être transportés et se déposer aussi sur la cathode constituant une impureté dans le cuivre. Ils sont heureusement incompatibles avec les ions sulfate et précipitent, donnant PbSO4(s).
Les ions Au3+ et Ag+ se réduiraient en Au et Ag immédiatement sur le cuivre: Insolubles ils