Il y a une chtit' différence parceque
F = qe x N
= 96352 C.mol-1 alors que l'on prend
F = 96500 dans les calculs. 
Variante de calcul: I = 1000A : En 1 seconde 1000 C sont transportés: quel nombre d'électron est mis en jeu?
ne = Q/qe = 1000/1,9.10-19 = 6,25.1021
Il faut 2 électron pour 1 cuivre.En 1 seconde nCu = ne/(2xN) = 5,189.10-3 mol
Masse de Cu en 1 seconde :
nCu x MCu = 0,3295 g C'est le débit de cuivre transporté
débit x Dt = 5102.103 g
D'où on tire Dt = 1,548.107 s
Il y a une chtit' différence parceque
F = qe x N
= 96352 C.mol-1 alors que l'on prend
F = 96500 dans les calculs. 
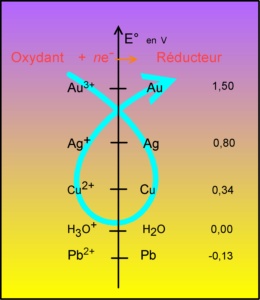
Il me semble que le corrigé officiel est bizarre.
a) à la cathode
Cu2+(aq) + 2e- ---> Cu(s)
à l'anode
Cu(s) ---> Cu2+(aq) + 2e-
b) 5 t = 98% de la masse d'anodes impures:
mimpures x 0,98 = mCu raffiné
mCu raffiné = 5000/0,98 = 5102 kg
soit 5102 / 0,0635 = 80347 mol de cuivre pur.
c) Il faut 2 F pour traiter 1 mol de cuivre
Q = 2Fx 80347 C = IxDt
Dt = 2x96500x80343/1000 = 1,55.107 s
soit 179 j