A) Simplifions le film de la réaction. Toutes les étapes intermédiaires peuvent être racontées par un seul dessin dans lequel nous appelons x l'avancement de la réaction à l'époque ti.
x part de 0 au début de la réaction, il augmente et ne peut dépasser la valeur qui rend nulle la quantité de matière de l'espèce chimique A. La valeur finale de x est xf.
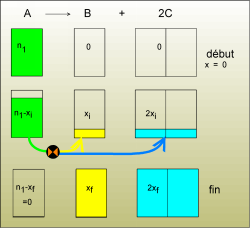

B) On calcule les quantités obtenues des espèces chimiques B et C à partir de la valeur xf calculée. xf = n1 dans cet exemple
nB = n1
nC = 2.n1
Il est temps de remarquer que nous avons écrit l'équation bilan de manière à ce que le réactif limitant (celui dont l'épuisement arrêtera la réaction, c'est A ) est 1. (cela n'est pas obligatoire mais tellement plus pratique !). Nous remarquons aussi que les facteurs qui donnent les quantités de produits B et C sont leurs nombres stoechiométriques.
C) La réaction traitée est parfaitement adaptée à la dissolution d'un soluté dans un solvant.
Je sais ... ce n'est pas une réaction chimique mais cela fonctionne quand même. Parceque la méthode est basée sur la conservation des éléments et qu'une dissolution respecte absolument cette loi.
Maintenant que nous savons ce qu'est l'avancement d'une réaction, il reste à traiter les cas de véritables réactions chimiques. La seule "difficulté" consiste à repérer le réactif limitant, le tableau est d'une aide précieuse.
