A) Le gaz, dissous dans un liquide, même si il se trouve en déséquilibre, peut rester dans un état métastable.
Une agitation peut provoquer la perturbation qui va enclencher le retour vers l'équilibre des phases.
De l'eau pétillante dans un verre, après avoir bullé, a l'air semble ne plus contenir de CO2.
B) Pourtant, il y en a encore. L'agitation fait de nouveau apparaître beaucoup de bulles.
Sur la paille qui permet de boire ce breuvage, des bulles apparaissent. Des défauts de surface ou des poussières minuscules servent de germes de nucléation: localement, ces "défauts" créent un déséquilibre suffisant pour sortir de l'état métastable.
C) L'agitation permet, en fait de créer une perturbation qui déclenche l'évolution du système vers un état plus stable.
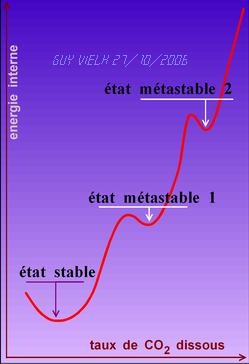
L'eau pétillante, dans le verre, après l'éruption de bulles qui suit le transvasement est dans un état "métastable".(l'état métastable 2 dans l'illustration du cadre D)
L'agitation "débloque" la situation et un nouvel état d'équilibre sera atteint.
D) Le nouvel état n'est pas nécessairement l'état stable d'équilbre thermodynamique. C'est en général un nouvel état métastable (l'état métastable 1 dans l'illustration ci-dessous).
E) De toutes manières, il est impossible de chasser complètement le gaz par cette méthode: on ne pourra pas dépasser l'état d'équilbre thermodynamique. Il y a du dioxyde de carbone dans l'air et il ne pourra pas ne plus y en avoir dans la phase aqueuse.
