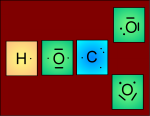
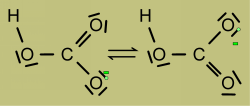
 La charge - est délocalisée
La charge - est délocalisée
C : Z = 6
O : Z = 8
. . C : ..... . ..... . .. . . . ....O : ..... ... ..... ... .. . ... O : ..... ... ..... ... .. . ... O : ..... ... ..... ... .. .

 La charge - est délocalisée
La charge - est délocalisée

Ion polyatomique
. ............ C : ..... . ..... . .. . . ..3O : 3(..... ... ..... ...) .....
H : . ... .
charge .
Test de reconnaissance de l'ion hydrogénocarbonate. Pour un ion dissous: une solution limpide.
HCO3- + H+-----------> CO2(g) + H2O
ce gaz recueilli, barbottant dans le d'eau de chaux
CO2 + Ca(OH)2 -----------> CaCO3 précipité.
Un excès de CO2 dissout le calcaire:
CaCO3 + CO2 + H2O ------> Ca2+ + 2HCO3-
L'ion HCO3- donne un pH très légèrement basique à ses solutions.
AH2 + H2O = AH- + H3O+ constante K1
AH- + H2O = A2- + H3O+ constante K2
K1 = [AH- ].[H3O+ ] / [AH2 ] ; pK1 = 3,9
K2 = [A2- ].[H3O+ ] / [AH- ] ; pK2 = 10,3
K1 x K2 = [H3O+ ]2.[A2- ] / [AH2 ] (rel Z)
le bilan matière impose que
[AH- ] + [AH2 ] + [A2- ] = c
la conservation de la charge impose
2[A2- ] + [AH- ] + [OH-] = c + [H3O+ ]
Le pH étant voisin de 7 on peut négliger [H3O+ ] et [OH-] . Il reste que [A2- ] = [AH2 ]
Cette égalité portée dans la relation Z, il vient que pH = 0,5(pK1+pK2)
pH = 7,1
