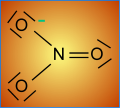
Structure.
N : K2 , L5 = N: 1s2,2s2,2p3
O : K2 , L6 = O :1s2,2s2,2p4
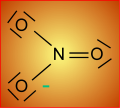
..N : Z = 7
................ .. ......... ...... .......................O : Z = 8 ................ ... .O : ..... ... . ..... ...
les atomes sont neutres, on ne regarde pas les neutrons car leur rôle est nul.
Structure.
N : K2 , L5 = N: 1s2,2s2,2p3
O : K2 , L6 = O :1s2,2s2,2p4


Ion polyatomique
...................N : ..... .. ......... ........ .. .
.........3O : 3( ..... ... ) ....... .................3( ..... ... ) ....... la charge : .
Tests chimiques de l'ion NO3-
NO3- + HCl -----------------> rien
NO3- + Ba2+ ---------------> rien
NO3- + Ag+ ----------------> rien
NO3- impossible d'obtenir des précipités ...
Test caractéristique (m'ouais ...)
2NO3- + 8H+ + 3Cu -----> 3Cu2+ + 2NO + 4H2O NO est oxydé en NO2 (vapeur rousses).
Bandelettes test pour les nitrates dans l'eau.
La représentation selon LEWIS est simpliste. Comme on peut s'en douter, la liaison de coordinence , une fois formée, plus personne ne peut la reconnaître: elle est comme les autres. Il y a délocalisation de 6 électrons et on a coutume de représenter les formes extrêmes dites mésomères.
. 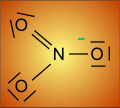 .
.