A) Chaque espèce chimique "contient" une certaine quantité d'énergie. Cela dépend de sa température, des interactions avec le solvant, de la forme de la molécule ...
Lorsqu'on mélange les réactifs, on se situe à un certain niveau dans l'échelle des énergies.
Il en est de même pour les produits. Il y a très peu de "chances" pour que
réactif 1 + réactif 2 + ... --------------> produit1 + produit 2 + ...
énergie de l'état de départ . ...... ... ... .. énergie de l'état final
Remarque: il y a une différence selon que la réaction est faite à volume constant (réacteur fermé) ou à pression constante ( réacteur ouvert). On distinguera donc l'énergie de réaction à volume constant notée Qv et la l'énergie de réaction à pression constante notée Qp. (n = nombre de mol de gaz et donc Dn est la variation de la quantité de matière de gaz)
Qp = Qv + Dn R.T = DH (= variation d'enthalpie)
B) le niveau d'énergie de départ et celui d'arrivée soient égaux.
La différence est l'énergie de réaction.
Voici une réaction endothermique qui nécessite un apport d'énergie sans lequel elle ne peut se dérouler:
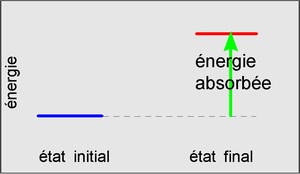
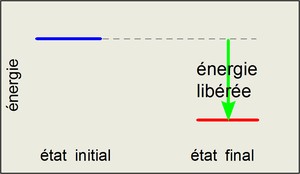
réaction exothermique : un dégagement d'énergie sous forme de chaleur très souvent.(exemple: la combustion)

diagramme énergétique d'une réaction athermique qui ne produit ni n'absorbe d'énergie ( c'est à peu près le cas de l'estérification)
