A: Que ce soit le modèle de la liaison chimique de Lewis ou bien la LCAO, on aboutit à un os: on ne peut obtenir les angles entre les différentes liaisons covalentes sans fabriquer un nouveau concept. Il est juste de dire que certaines méthodes plus "rock'n roll" de la chimie théorique passent l'obstacle ..................................... Mais elles sont loin d'avoir le charme d'être expliquables avec des gestes et des petits dessins.

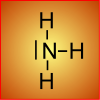
B: La méthode de Lewis est rapide, elle donne un résultat de bonne qualité: N est entouré de trois liaisons covalentes et d'un doublet non partagé.
 ..............
C: On forme une liaison covalente en mettant en commun
un électron venant d'un H avec l'électron impair de l'orbitale 2px
. La flèche rouge représente cet échange.
..............
C: On forme une liaison covalente en mettant en commun
un électron venant d'un H avec l'électron impair de l'orbitale 2px
. La flèche rouge représente cet échange.
On recommence avec 2py et 2pz ce qui va amener deux H encore à se joindre à l'édifice.

D: le doublet non partagé serait 2s de l'azote. Cependant, une fois la molécule formée, les doublets se déplacent et on ne peut plus savoir d'où proviennent les électrons formant les doublets (partagés ou non)
E: Voici l'os: sii on garde la géométrie des orbitales atomiques de l'azote, on a : le doublet non partagé qui a une symétrie sphérique. Les trois doublets liants sont perpendiculaires entre eux.
Par les mesures physiques on sait que les angles sont de 107° et pas de 90° entre les doublets liants.
Il faut trouver une solution à ce problème (grave!)
