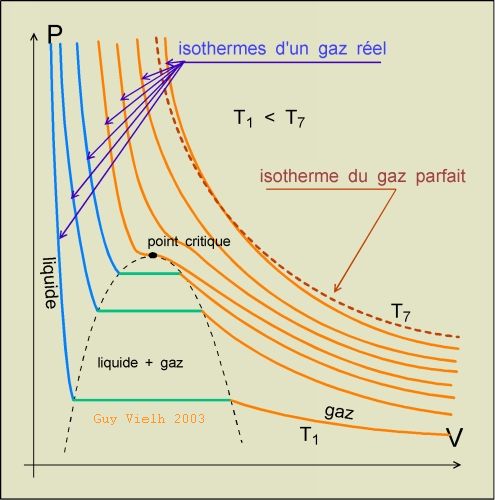
Lorsque la température est supérieure à la température critique qui est ici T4, le gaz ne peut passer par l'état liquide. L'état liquide n'existe pas pour cette espèce chimique, à ces températures.

Pour le gaz parfait, la loi de Mariotte exprime que le produit P.V reste constant pour une température fixée T1 par exemple.
Sur un graphique la représentation de cette loi est une branche d'hyperbole.
Si on change la température pour une nouvelle
valeur T2, on obtient encore la constance du produit P.V mais ce n'est pas la même valeur que pour T1.
On a une autre branche d'hyperbole, plus haute que celle donnée
à T1. L'ensemble de ces isothermes ressemble à ceci.