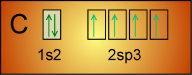
Il faut donc envisager une hybridation des orbitales atomiques pour C et O
 .
. 
 .
. 
 .
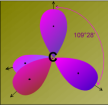
. 
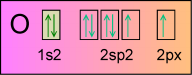 .
.
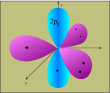
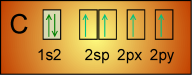
Il faut donc envisager une hybridation des orbitales atomiques pour C et O
 .
. 
 .
. 
 .
. 
 .
.

Formons le CO2. Commençons par voir ce que dit Lewis.


 Il faut former deux doubles liaisons C=O soit l'écriture de Lewis:
Il faut former deux doubles liaisons C=O soit l'écriture de Lewis:
<O=C=O>
Il est clair qu'on ne peut rien espérer de la forme de base des orbitales atomiques du carbone:
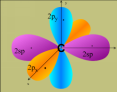
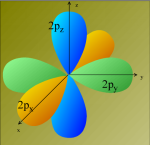 L'orbitale
2s n'est pas représentée mais elle doit participer pour que
4 liaisons s'établissent.
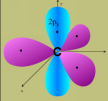
L'orbitale
2s n'est pas représentée mais elle doit participer pour que
4 liaisons s'établissent.