 Comme tout s'arrange ... c'est exactement ce que dit VSEPR. Et le bon sens
aussi.
Comme tout s'arrange ... c'est exactement ce que dit VSEPR. Et le bon sens
aussi. Comme tout s'arrange ... c'est exactement ce que dit VSEPR. Et le bon sens
aussi.
Comme tout s'arrange ... c'est exactement ce que dit VSEPR. Et le bon sens
aussi.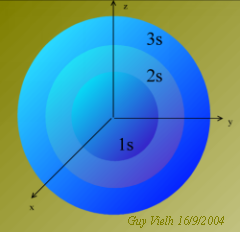

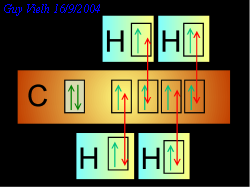
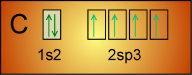
Dans le cas de la formation du méthane CH4. Si on laisse le carbone écrit:
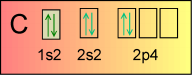
On ne respecte pas la "règle des doubles sièges". Mais cette écriture la respecte:

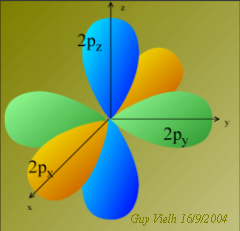
En faisant cela, nous avons admis que les orbitales 2s et 2p avaient la même niveau d'énergie. Lorsque l'atome est dans son état fondamental ce n'est pas vrai.
Nous avons combiné les quatre orbitales, ainsi, elles ont le même état énergétique. Nous avons hybridé les orbitales Qu'en dit Schrödinger?