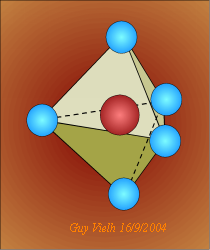
Pour que les 5 G.E.D. soient les plus écartés possibles, la géométrie est l'hexaèdre.
En faisant cela, nous avons admis que les orbitales et avaient la même niveau d'énergie. Lorsque l'atome est dans son état fondamental ce n'est pas vrai.
Mais nous avons combiné les quatre orbitales, ainsi, elles ont le même état énergétique. Qu'en dit Schrödinger?
Schrödinger s'en accommode très bien. La géométrie des orbitales est fortement modifiée.
Pour les modèles moléculaires: la structure pentagonale est à utiliser.
 .
.

Dans le cas de la formation du pentachlorure de phosphore. Si on laisse le phosphore écrit:
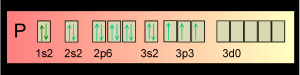
On comprend que P est trivalent et on ne voit pas comment il pourrait devenir pentavalent. D'autant que la règle de l'Octet grince des dents!
Mais si mous écrivons le phosphore ainsi:

Nous constatons que P est pentavalent puisqu'il peut échanger 5 électrons.