e) le rendement r = quantité obtenue / quantité d'après la stoechiométrie de la réaction.
nobtenue = m/M = 1,52 / 122 = 0,0125 mol
voyons la quantité stoechiométrique: tableau d'avancement...
la quantité stoechiométrique d'acide est 0,021 mol
r = 0,0125/0,021 = 0,59 soit 59%
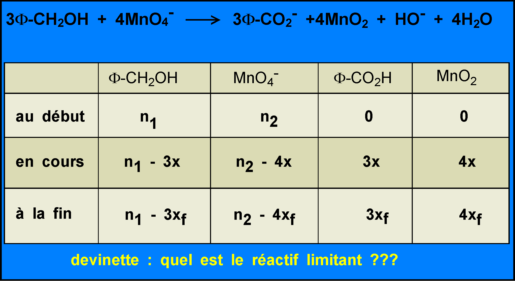
n1 = V.r/M = 2,4 x 1,04 / 108 = 0,024 mol
n2 = m/M = 4,5/158 = 0,028 mol
C'est le permanganate qui est le réactif limitant car lorsque x atteint la valeur xf = 0,028 / 4 = 0,007 mol le réactif 2 est épuisé alors qu'il reste 0,024 - 3x0,007 = 0,003 mol d'alcool benzylique. Ce qui est du gâchis car c'est le réactif précieux: on voit là que c'est un problème avec piège pour emmerder les candidats. (Un bénol: si l'oxydant avait été "en excès" l'ion MnO4- eut été dans la phase aqueuse et on ne sait comment s'en débarasser).
2 manipulation 2
a) Dans l'ampoule à décanter, le dichlorométhane ( d = 1,32) est au fond. Lorsque les phases on été séparées, faire tomber une goutte d'eau dans le liquide: si elle disparaît, c'est la phase aqueuse. Si elle reste sans se mélanger: c'est la phase organique.
la phase aqueuse contient les ions : benzoate , Na+ , K+ et HO-
b) C6H5CO2- + H3O+ + Cl- =
C6H5CO2H + H2O + Cl-
c) l'acide benzoïque formé par cette dernière réaction est "peu soluble" dans la phase aqueuse, il apparaît sous forme de cristaux insolubles.
d) plus la température est basse moins l'acide benzoïque est soluble dans l'eau c'est ainsi que l'on en récupère le plus.