 échelle des pKa
échelle des pKab) dans ce liquide, il reste donc HA solide qui irritera la muqueuse gastrique.(Et si on mettait 100 mL d'eau? tout se dissolvrait...)
c) La solution est saturée, sa concentration massique est cs , nous avons besoin de sa concentration molaire [HA] = cs / MHA = 3,4/180 = 0,0188 mol.L-1
Si HA était un acide fort son pH serait donné par pH = -log [HA] = 1,72
or, le pH mesuré =2,5 . Toutes les molécules de HA(aq) ne sont pas dissociées en H+(aq) + A-(aq) . C'est la caractéristique des acides faibles de n'être pas totalement dissociés.
 échelle des pKa
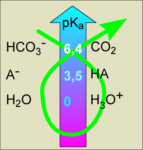
échelle des pKa3) a) soit la réaction HA(aq) + H2O = H3O+(aq) + A-(aq) .................................... sa constante d'équilibre Ka = [H3O+(aq)]. [A-(aq)] / [HA(aq)] ce qui , en prenant les log donne pKa = pH - log [A-(aq)] / [HA(aq)]
lorsque pH = pKa cela entraine que [A-(aq)]
= [HA(aq)]. Lorsque pH < pKa cela entraine
que [A-(aq)] < [HA(aq)]..........................................................
........ .............. ................ donc, à pH=8,3 l'espèce dominante
est A-(aq) pour le couple HA/A- . Et HCO3-(aq)
domine sur CO2(g). car pKa = 6,4 pour ce couple.
................ donc, à pH=8,3 l'espèce dominante
est A-(aq) pour le couple HA/A- . Et HCO3-(aq)
domine sur CO2(g). car pKa = 6,4 pour ce couple.
b) Entre deux couples K
= K1/K2 . Dans l'estomac, il apparait donc CO2 (burrrp ... pardon) et
HA. L'acide chlorhydrique en excès contraint les réactions des
acides faibles vers la droite dans l'échelle des pKa (image en bas
à droite). La concentration de HA atteint-elle
cs ? 0,50 / 0,1 = 5 g.L-1 > cs
. Tout HA n'est pas soluble, il précipite sous forme de fins cristaux
qui n'ont pas le pouvoir irritant. (en emporte le vent). nAH =
0,5 / 180 = 2,77 mmol venant de la même quantité de NaA soit
0,561 g d'acétylsalicylate de sodium la
différence étant NaHCO. Sa masse = 0,80 - 0,561 =
0,239 g. 
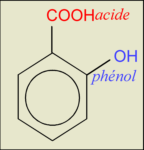 pKa = 3,0 (le plus fort)
pKa = 3,0 (le plus fort)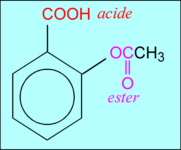 pKa = 3,5
pKa = 3,52 Tentative de dissolution d'un cachet d'acide acétylsalycilique dans 50 mL d'eau.
Si le cachet se dissolvait totalement, on obtiendrait une solution de concentration :
c = 0,32 /0,05 = 6,4 g.L-1 mais la solubilité cs est de 3,4 g.L-1. Par conséquent le cachet ne peut se dissoudre complètement.