K2 = [B2-(aq) ].[H3O+(aq)]/[B2H(aq) ]
En regardant la définition de K, on reconnaît des morceaux de K1 et de K2, on constate que:
K = K1/K2
Voici un résultat intéressant:
si K1 > K2 (entraîne pK1 < pK2) l'acide du couple 1 est plus fort que l'acide du couple 2. On a tout de suite la constante d'équilibre de leur compétition selon l'équation D.
K = 10(pK2-pK1)
Pour connaître l'issue du combat entre deux couples acide bases on pratique la recette du gamma: On classe les couples en mettant celui qui a le plus petit pKa en haut: c'est le plus fort. L'issue de la compétition suit la flèche orangée:
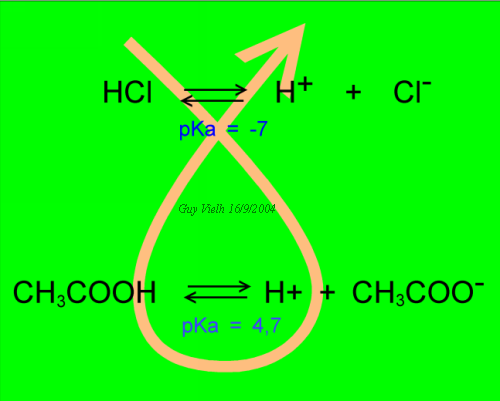
L'affrontement entre deux couples acide base s'écrit:
B1:H + B2:- <===> B1:- + B2:H équation (D)
L'acide le plus fort est celui qui impose le proton à la base conjuguée de l'autre couple.
La loi d'action de masse s'écrit
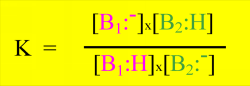
La force d'un acide est caractérisée par le pKa qui est la constante d'équilibre dans sa réaction sur l'eau:
B1H(aq) + H2O = B1-(aq) + H3O+(aq)
K1 = [B1-(aq) ].[H3O+(aq)]/[B1H(aq) ]
pour l'autre couple: B2H/B-