b) à pH = 6 , pour les deux acides, on se trouve largement dans la zone de prédominance de A-.
log [A-(aq)] / [HA(aq)] = pH - pKa
montre que la concentration en A- est au moins 101,9 celle en AH
Pour le couple HCO3-(aq)/CO2(aq), il y a pratiquement égalité entre les deux formes avec léger avantage à CO2(aq).
 ...
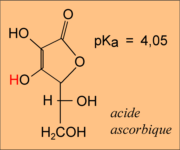
... 
m1 = 0,330 g M = 180 g/mol :: m2 = 0,200 g M = 176 g/mol
 .
. 
a) On classe les couples par ordre de pKa décroissant comme sur la figure à droite, en bas et on voit le sens des réactions acidobasiques.
Les deux acides provoquent le dégagement de CO2 (gazeux?). D'après l'énoncé HCO3- est en excès. Pour les deux acides, l'équation s'écrit:
HA(aq) + HCO3-(aq) ---> A-(aq) + H2O + CO2(aq)
La constante d'équilibre
K = {[A-(aq)].[CO2(aq)]}/{[HA(aq)].[HCO3-(aq)]}
On y reconnait que K = KaHA / KaHCO3
K1 = 10(-3,5+6,4) = 102,9
K2 = 10(-4,1+6,4) = 102,3
Elles sont quasi totales (plus de 99%)