Un comprimé = quelqu'un qui a reçu une médaille. Comment? ah! un con primé ... mmmouais.
comprimé a servi à produire le HCO3-(aq) encore présent et a servi aussi à faire tous les ions A1- et A2- :
quantité de HCO3-(aq) = V.[HCO3-(aq)]=1,35 mmol. Utilisée pour les acides 2,93 mmol
Il devait y avoir dans le comprimé: 4,28.10-3 mol de NaHCO3
soit 4,28.10-3 x 84 = 0,36 g
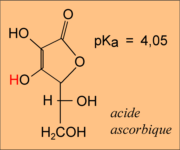
Désolé pour les petites différences dans les pKa : j'ai conservé ceux de l'exercice 6 à cause des dessins.
 ...
... 
m1 = 0,330 g M = 180 g/mol :: m2 = 0,200 g M = 176 g/mol
 .
. 
c) quantité de CO2 produite? Puisque les réactions acide base ont été totales, appelons n1 la quantité de HA1 et n2 celle de HA2:
n1 + n2 = m1/180 + m2/176 = 2,97.10-3 mol
se dégageant dans dans 100 mL d'eau .
Elle pourrait dissoudre 3,4.10-3 mol de CO2(aq) il ne devrait donc pas y avoir de bulle. Y'a une erreur dans l'énoncé (volume d'eau?).
e) admettons que la concentration en CO2(aq) soit à saturation : [CO2(aq)] = 0,034 mol.L-1
log [HCO3-(aq)] / [CO2(aq) ] = pH - pKa
permet d'atteindre [HCO3-(aq)]
[HCO3-(aq)] / [CO2(aq) ] = 10-0,4
[HCO3-(aq)] = 0,0135 mol.L-1
f) la quantité de HCO3- présente dans le