A) Comme on le comprend facilement, il y a autant d'électrons s'agitant autour de l'atome que de protons dans son noyau. Ainsi les atomes sont neutres.
Un atome de 50 protons doit être entouré d'un essaim de 50 électrons alors qu'un atome formé d'un seul proton dans son noyau n'a aussi qu'un seul électron dans son essaim. Il sera plus petit que le celui qui en a 50.
l'élement de symbole :
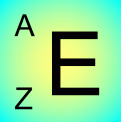
contient Z protons dans son noyau ainsi que A-Z neutrons .
C) Le nombre de protons contenus dans le noyau est la carctéristique essentielle: ce nombre, on l'appelle NUMERO ATOMIQUE.
Z est la lettre qui le représente, c'est un nombre entier naturel. Comme nous l'avons démontré, l'atome est électriquement neutre. Cela signifie qu'il y a Z électrons qui s'affairent autour de ce noyau.
Il y a des neutrons dans le noyau, ils servent de "colle". Leur nombre est obtenu en faisant A-Z. Ce nombre de neutrons n'est pas une caractéristique pour la nature de l'élément chimique.
Deux atomes ayant le même nombre de protons appartiennent au même élément. Si leur nombre de neutrons n'est pas le même, ils sont ISOTOPES de l'élément par Z.
.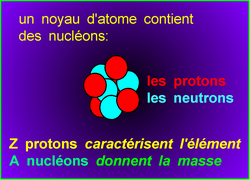
Dans cette image, on voit 4 protons et 4 neutrons. Z = 4 et A = 8.
B) C'est Z = nombre de protons qui caractérise l'élément chimique.
Tous les noyaux contenant Z protons appartiennent à l'élément chimique dont le numéro atomique est Z. ........ Ce ne sont pas nécessairement des atomes, les ions font aussi partie de l'élément.
Connaître Z c'est connaitre le nom de l'élément et son symbole.
