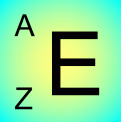
l'élement de symbole E contient Z protons dans son noyau et A-Z neutrons .
B) Voici, à droite, une partie des représentants de l'élément cuivre:
Combien d'isotopes sont montrés ? six. Le cuivre 61, 62, 63 , 64 , 65 , 66 . Dans les formules chimiques, lorsque A n'est pas précisé, il faut comprendre qu'il s'agit de l'élément naturel. C'est le cuivre que l'on extrait de la nature, il est constitué du mélange des isotopes 63 et 65 dont la teneur est indiquée.
La teneur en chaque isotope est assez uniforme sur toute la terre (dans certains cas,la finesse des analyse peut toutefois identifier de quelle mine l'élément a été extrait), et varie assez peu d'une planète à l'autre. Les atomes étant créés lors du catacysme stellaire qui s'est produit avant que le soleil ne se forme il y a plus de 5,5 milliards d'années. Cette histoire est contée dans la nucléosynthèse.
La masse de deux isotopes n'est pas la même. C'est pratiquement la seule chose qui les différencie. Pour le chimiste, deux isotopes d'un même élément sont quasiment indiscernables.
Le spectrographe de masse permet de les séparer et de donner la composition centésimale en chaque isotope.
Certains des isotopes n'existent plus dans la nature parcequ'ils sont instables et se désintègrent spontanément. Mais on sait les fabriquer dans un accélérateur de particules.
A) Deux atomes ayant le même nombre de protons appartiennent au même élément. Si leur nombre de neutrons n'est pas le même, ils sont ISOTOPES de l'élément caractérisé par Z.
un exemple:
l'élément cuivre nous présente quelques noyaux d'atomes de sa communauté:
