A) Au sens premier: une réaction est limitée quand elle ne va pas jusqu'à épuiser au moins un des réactifs.
Curieusement, il reste des réactifs qui "ne réagissent pas.
Cela est fort vexant pour un chimiste débutant. On rencontre ce cas dans les réactions d'estérification par exemple pour la synthèse d'un arôme comme l'acétate d'isoamyle.
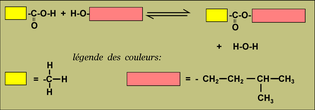
B) Pourquoi diable, cette réaction ne consomme-t-elle pas tous les réactifs ?
La raison est qu'une réaction se produit également entre l'eau et l'ester formé pour donner ... l'acide et l'alcool qui sont les réactifs de la première réaction.
Ce que la réaction "vers la droite" fait, la réaction inverse le défait.
D) On a un équilibre dynamique. Continuellement des produits sont fabriqués et certains servent de réactifs à la réaction inverse.
Lorsque la réaction est "terminée" car on ne voit plus les quantités de chaque espèce chimique changer, il continue à se passer quelque chose au niveau des molécules.
Si la réaction inverse est rapide, on verra peu de produits se former.
Si la réaction inverse est paresseuse, on verra beaucoup de produits.
Si elles sont aussi rapides l'une que l'autre l'équilibre se fera avec 50% de réactifs restants et 50% de produits formés.

