Si kd > ki : il y aura plus de produits que de réactifs dans l'état stationnaire.
Si kd < ki : il y aura moins de produits formés que de réactifs restant dans l'état stationnaire. C'est un cas défavorable au rendement de la réaction et on aura tout intérêt à déplacer l'équilibre vers la droite.
Les moyens d'action ne sont pas très variés: la température n'aura d'influence que sur le temps pour atteindre l'état stationnaire, pas sur l'équilibre. Un catalyseur accélère les deux réactions.
Il faut faire disparaître un des produits formés et, ainsi la réaction inverse ne pouvant se dérouler, la réaction deviendra totale.
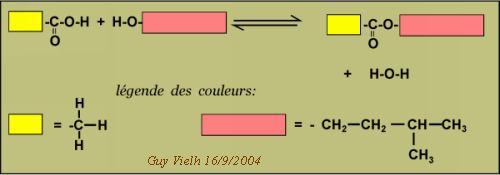
La réaction de gauche à droite a une vitesse:
taux de consommation de l'acide = kd. concentration en acide x concentration en alcool
- d[acide]/dt = kd.[acide].[alcool]
La réaction de droite à gauche a une vitesse : taux de consommation de l'ester = ki . concentration en ester x concentration en eau.
-d[ester] / dt = ki.[ester].[eau]
Lorsque la réaction ne progresse plus, c'est que les taux de disparition des espèces chimiques sont égaux :
kd.[acide].[alcool] = ki.[ester].[eau]
donc kd/ki = [ester].[eau] / [acide].[alcool]=K