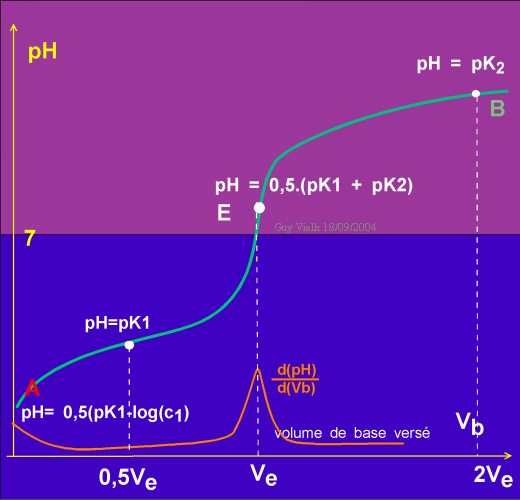
En B, il y a autant de base non dissociée que d'acide conjugué de cette base, on se retrouve dans les conditions de la solution tampon mais du deuxième couple cette fois.
et [OH-] négligeable devant [B-] , il vient donc [AH+]= [B-] et aussi [BH] = [A]
K1 = [B-] . [H+] / [BH]
K2 = [A] . [H+] / [AH+] en faisant le produit
K1 . K2 = [B-] . [H+] . [A] . [H+]/( [BH] . [AH+])
Après simplifications K1 . K2 = [H+]²
d'où, 2pH = pK1 + pK2 (point E)
En B, il y a autant de base non dissociée que d'acide conjugué de cette base, on se retrouve dans les conditions de la solution tampon mais du deuxième couple cette fois.
Il faut aimer les complications pour doser effectivement une base faible par un acide faible !!!
Cependant, même si on ne le fait pas, il est intéressant de comprendre comment évolue le pH dans ces conditions.
On appelle 1 l'acide et 2 la base.
A la demi neutralisation 0,5Ve versé, la moitié de l'acide a été neutralisé: [B-]= [BH]
K1 = [B-] . [H+] / [BH] alors K1 = [H+] et
pH = PK1 c'est une solution tampon
A la neutralisation Ve a été versé, la concentration des deux ensembles est la même: [B-]+ [BH] = [A] + [AH+]
La neutralité électrique impose:
[H+] + [AH+]= [B-] + [OH-] avec, comme on est au point d'équivalence [H+] négligeable devant [AH+]