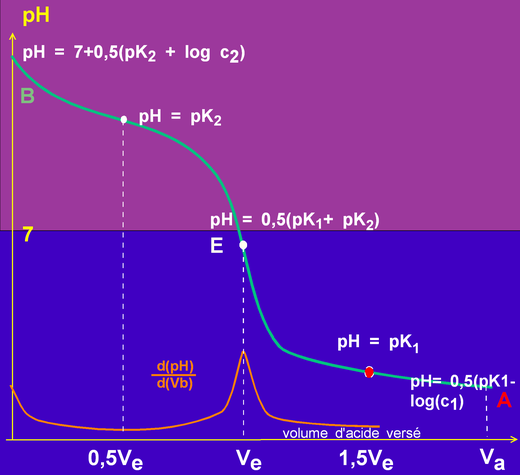
En continuant à verser de l'acide faible on s'acheminera vers le pH de l'acide faible seul :
pH = 0,5(pKa - log Ca))
La dilution de l'acide n'est alors sans doute plus négligeable ...

Ce ne sont pas de bonnes conditions pour un dosage car le point d'équivalence est moins net qu'avec un acide fort.
Toutefois, il est intéressant de comprendre par quels points passe la courbe du pH pendant le dosage.
Comme je suis fatigué de toujours dire pareil, simplifions:
en B, on une base faible, le pH est celui d'une base faible évidemment!
A la demi neutralisation, on a la solution tampon du couple de la base (noté 2)
A la neutralisation, on a en présence les ions des deux couples, en concentrations égales on est exactement dans le même cas que celui du dosage d'un acide faible par une base faible
On continue à ajouter de l'acide faible et lorsque la quantité versée est 1,5Ve on a une solution tampon de l'acide et de sa base conjuguée. (couple noté 1)