La conductivité de cette solution va diminuer pendant le dosage
car [HO-] diminue, ce sont des ions qui ont une grande conductivité
ionique molaire . Les points (i, si)
sont sur un segment de droite descendant.
Une fois le point d'équivalence franchi,
la formule donnant la concentration des ions spectateurs reste valable
mais:
[HO-] = 0 et [H+] = ( i - Ve)[a]/(Vb + i)
Ve est le volume équivalent (celui pour lequel
la quantité des ions HO- et H+ versés est la même
Les points (i, si)
sont alignés sur un segment ascendant.
Les deux segments se coupent au point d'équivalence.
C'est un dosage comme les autres. Mais on mesure la conductivité
après chaque mL de solution titrée versé.
Prenons un exemple: le dosage de NaOH par HCl. NaOH est dans le
becher, [b] est sa concentration. Vb le volume de l'échantillon dosé.
On tient HCl dont le titre [a] est connu dans la burette .
Na+ et Cl- sont des ions spectateurs. On verse 1 mL , on mesure la conductivité,
puis on verse encore 1 mL ... soit "i" l'étape du dosage.
Tous les volumes sont en mL
[Na+] = Vb.[b] / ( Vb + i )
[Cl-] = i.[a] / ( Vb + i )
avant la neutralisation [H+] = 0 en 1° approximation et [HO-] = (Vb
. [b] - i . [a] ) / ( Vb + i )
CONDUCTIMETRIE DOSAGES
G
Vielh 2004 révision 2008 niveau 9
 Matériel
classique pour les dosages
Matériel
classique pour les dosages
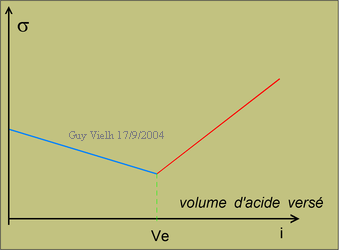 La cassure entre les deux séries de points est très franche
permettant une bonne détermination du point d'équivalence. Meilleure
qu'avec les pH mètres. De plus, le conductimètre est un instrument
beaucoup moins exigeant en entretien.
La cassure entre les deux séries de points est très franche
permettant une bonne détermination du point d'équivalence. Meilleure
qu'avec les pH mètres. De plus, le conductimètre est un instrument
beaucoup moins exigeant en entretien.
