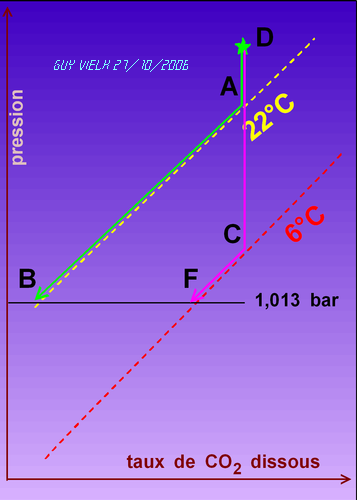
Si l'eau avait est à 22°C, le système en descendant rencontre le point A, et en ce point les bulles apparaissent. Le système glisse sur la courbe jaune jusqu'au point B .
Pourquoi plus de bulles se forment selon ce chemin ? Par ce que le taux de gaz dissous est plus faible à 22°C: cela fait sortir plus de CO2 de l'état "dissous". Cela fait plus de bulles.
Si on laisse le liquide à 6°C se réchauffer dans le verre, on constate l'apparition continue de bulles. Pendant que le liquide se réchauffe, on parcourt le trajet FB.
Du gaz dissous sort du liquide...
Mais tout le monde a remarqué cela !

Dans la bouteille ou la canette, le système est dans l'état "D" ( comme départ)
L'ouverture de la bouteille fait sortir le système de son état à 3 bars (valeur imposée par la machine d'embouteillage). Le système, livré à lui même évolue suivant un chemin quelconque sur le schéma.
Nous imaginons, pour notre raisonnement, qu'il suit un chemin facile à décrire:
Pour une eau pétillante à 6°C la pression baisse jusqu'en C sans apparition de bulle. En C on rencontre la courbe de solubilité du CO2 à 6°C. Les bulles apparaissent, aux dépens du gaz dissous.
On parcourt le segment CF. En F la pression de CO2 gazeux dissous est égale à la pression atmosphérique. On reste en F tant que le température reste à 6°C.