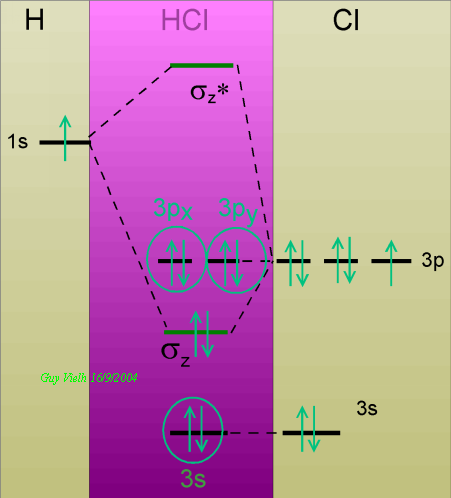
L'orbitale atomique 3s du chlore est très éloignée du niveau d'énergie de 1s de l'hydrogène. Et puis elle contient déjà deux électrons.
C'est 3pz qui donne la combinaison, deux orbitales moléculaires sont créées. Les deux électrons, l'un donné par H l'autre par Cl s'installent dans l'orbitale liante parcequ'elle a le niveau d'énergie le plus bas. Il n'y a pas d'électron dans l'orbitale moléculaire antiliante:Bilan un doublet partagé. Trois doublets non partagés, pas de doublet non liant. C'est exactement ce que disait Lewis.
Mais Lewis ne peut expliquer pourquoi la liaison est dissymétrique: le doublet est quasiment monopolisé par Cl, les coefficients a1 et a2 permettent de trouver le pourcentage. Cette dissymétrie a comme conséquence que la molécule porte un dipôle électrique mesurable. Et que la mesure est en très bon accord avec ce que pronostique la LCAO.

Lorsque les deux atomes sont différents, quelles orbitales vont pouvoir participer à la combinaison linéaire?
Il faut qu'elles se recouvrent.
Elles doivent avoir la même symétrie
Les énergies ne doivent par être trop différentes.
Deux orbitales contenant un doublet chacune va donner une orbitale liante et une autre antiliante pleines: bilan nul. On ne les fera pas participer.
Voyons le cas HCl:
Les orbitales qui ne participent pas sont 3px et 3py: elles ne recouvrent pas l'orbitale 1s de l'hydrogène et, contenant deux électrons elles ne contribueraient pas à la stabilité de la molécule.