
Vous pouvez voir un autre exemple de double liaison dans la cas de la molécule de CO2 et un autre dans le cas de la molécule d'éthylène


Reprenons l'exemple de la formation de la liaison entre les deux atomes d'oxygène dans la molécule de dioxygène O2.
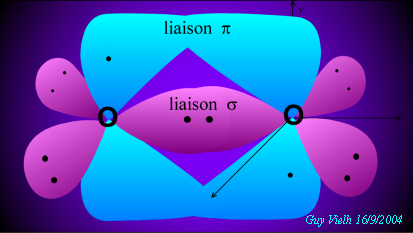
Le premier acte de la formation de cette molécule est la formation de la liaison sigma.
L'ébauche de la molécule est donnée dans le dessin du haut.
Cette molécule n'est pas finie car on voit deux orbitales (bleues) contenant un électron célibataire. On peut former une autre liaison.
Cependant il n'y a pas de recouvrement axial possible. Les orbitales 2py peuvent se recouvrir LATÉRALEMENT. Cela va conduire à un nuage double, contenant deux électrons qui forment un autre doublet liant: la liaison pi.