Q est le "quotient de la réaction"
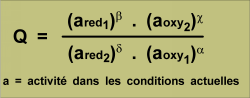
K est la constate d'équilibre de la réaction: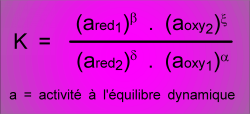
Soit la réaction d'oxydoréduction, bilan des deux demi réactions d'électrode:
a . Ox1 + d . Red2 <=========> b.Red1 + c. Ox2
Elle s'accompagne d'une variation d'enthalpie libre
DG = DG° + RT. Ln Q relation (A)
Lorsque cette réaction inversible parvient à l'état stationnaire d'équilibre c'est parce que DG = 0
Alors DG° = -RT.Ln K
Si cette réaction se produit dans une pile avec un courant très petit, alors la variation de G est égale au travail des électrons dans le circuit électrique qu'alimente cette pile:
DG = - n . E . F (négatif parce que la pile le fournit au circuit)
En reportant tout cela dans la relation (A) il vient:
E = E° - RT/(nF) Ln Q . . et E° = E°1 - E°2
ou encore: E = E° - 0,06/n . log Q = c'est la loi de NERNST
Première demi réaction:
. a Ox1 + ne- donne b Red1
le potentiel normal d'électrode est E°1
Deuxième demi réaction
. c . Ox2 + ne- donne d . Red2
le potentiel normal d'électrode est E°2. On choisit d'appeler (1) le couple dont le potentiel E°1 > E°2.
En raison de cette situation (voir la "règle" du gamma) la réaction jaune se produit de gauche à droite. La réaction mauve, de droite à gauche.
F = constante de Faraday = 96500C