Soit E = 0,34 - (-076) = 1,10 V
Naturellement dans une pile, on cherche à avoir la capacité maximale et les concentrations sont plus importantes (Cu(II)) . Pour Zn, c'est un métal solide, on ne peut jouer sur son activité qui vaut 1 .
Il n'est pas envisageable que la concentration dépasse 1,5 mol.L-1 car la solubilité des composés ioniques est de cet ordre de grandeur.
Revenir à séparation de 2 solides.

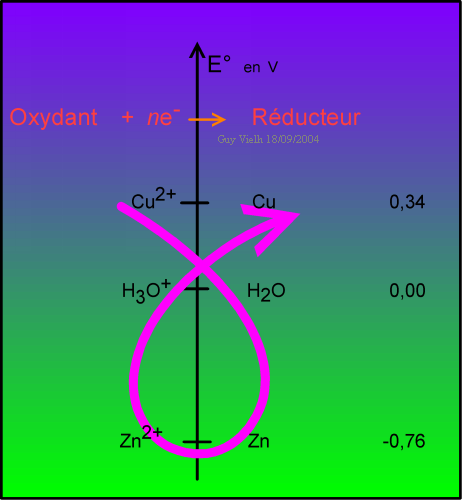
Le sens des réactions redox est donné par un moyen mnémotechnique: le sens du GAMMA.
Parce que Cu(II) est plus oxydant que Zn(II), il force la réaction du bas à régresser vers la gauche.
Une autre façon de dire les choses: l'ion Cu(II) a plus d'appétit pour les électrons que Zn(II).
La réaction du bas ne peut donc pas se dérouler de gauche à droite. Car Cu(II) pique les électrons du zinc.
Zn dépouillé de deux électrons se retrouve à l'état d'ions Zn(II).
Si les deux demi piles sont réalisées dans les conditions normales (concentrations = 1 mol.L-1) la différence de potentiel sera:
E = E°oxydant + haut - E°oxydant - haut