
VSEPR = cela veut dire :
Valence Shell Electron Pair repulsion .
La situation est souvent un peu plus sophistiquée que celle représentée dans la colonne de gauche. Il faut remplacer "doublets" par "groupe d'électrons dépendants" (GED).
Lorsqu'on a une double liaison: les deux électrons de la liaison s et les deux de la liaison p ne sont pas indépendants. Ils constituent un "groupe d'électrons dépendants". Il faut donc traiter ces deux doublets comme un seul objet.
On se trouve donc à la tête d'un ensemble de cas comportant deux, trois, quatre et même plus GED.
2 GED = atome central DIGONAL (exemple CO2)
3 GED = atome central TRIGONAL (exemple AlCl3)
4 GED = atome central TETRAGONAL (exemple CH4)
5 GED = atome central PENTAGONAL (exemple PCl5)
6 GED = atome central HEXAGONAL (exemple SF6)
7 GED = atome central HEPTAGONAL. (exemple IF7)
On retrouve naturellement ces géomètres en utilisant l' hybridation des orbitales atomiques de l'atome central.
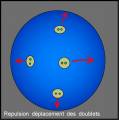
Les doublets glissent et se fuient

Ils se stabilisent à la répulsion minimale
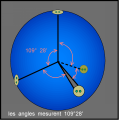
On représente les liaisons chimiques par des barres.