On n'a que très rarement à faire aux éléments parceque les atomes, sauf ceux des gaz nobles, ne restent pas isolés. Ils s'assemblent avec d'autres pour donner les espèces chimiques.
Comment les atomes tiennent-ils ensemble pour former les molécules, les ions polyatomiques, les cristaux ... ? .
Une règle contraint les atomes à avoir une structure électronique particulière. C'est la règle de stabilité ou règle de l'OCTET. .
Les atomes parviennent à satisfaire cette règle en échangeant des électrons de leur couche de valence.
La couche de valence est celle qui est la plus haute (en énerie) et contenant un (ou des) électron(s).
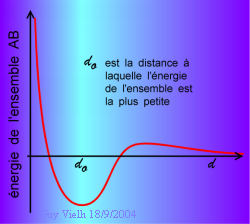
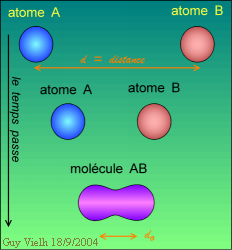
Si les atomes se lient c'est que l'état obtenu est plus stable. Les deux schémas ci-dessus montrent le rapprochement de deux atomes et leur liaison. A droite le diagramme montrant l'énergie de de l'ensemble (AB) en fonction de la distance entre eux. Le puits d'énergie corresond à la liaison chimique. Plus il est profond, plus elle est forte.
Plusieurs types de liaisons sont possibles: