Les réactions REDOX mettent en jeu des échanges d'électrons.
Deux demi réactions sont nécessaires: l'une fournira des électrons, l'autre les absorbera.
OxI + e- ----> RedI
OxII + e- ----> RedII
sont les deux couples en jeu
Si nous nouy y prenons mal, (en mélangeant les deux couples dans le même récipient) l'échange se fait directement par contact entre les différents couples sans que nous en tirions un bénéfice !
Pour simplifier supposons que nous réalisons les deux couples dans les conditions normales ( concentrations à 1 mol.L-1 )
Une pile électrochimique de démonstration: difficile de lui faire débiter plus que quelques dizaines de mA !
C'est la pile Daniell.
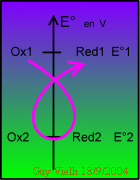
Dans le cas montré, le potentiel normal du couple I est plus haut que le potentiel normal du couple II.
L'oxydant du couple de plus haut potentiel oxyde le réducteur de l'autre couple. C'est ce que dit la règle mnémotechnique du gamma.
