A) On n'en connaît pas la raison profonde, peut être est elle purement mathématique .
Toujours est-il qu'une loi fondamentale contraint les atomes à faire évoluer leur effectif d'électrons comme un patron d'hotel cherche à éviter les étages partiellement remplis de clients pour économiser sur le chauffage et le ménage!
B) La loi dit: le nombre idéal d'électron dans la dernière couche est 8. On l'appelle règle de l'OCTET
Les premiers atomes de la classification échappent à cette loi parceque leur dernière couche est la couche K et qu'elle ne peut contenir que deux électrons.
Pour eux la règle est dite :"du DUET".
D) Voyons des cas où la règle de
l'OCTET triomphe: Tous les éléments avec Z < 20. 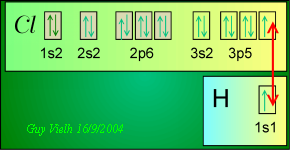 Pour Cl, la dernière couche est n=3 elle ne contient que 7 électrons,
encore un et c'est le paradis: H rêve de 2 électrons dans sa
dernière couche. Les deux atomes se disposent assez proche l'un de
l'autre pour que l'électrons de H soit si voisin de Cl qu'il puisse
être considéré comme logeant dans la demi case quantique
3p du chlore. Inversement, l'électron qui appartenait à Cl
se trouvera assez proche de H pour qu'il puisse aussi être considéré
comme logeant dans la case quantique 1s de H.
Pour Cl, la dernière couche est n=3 elle ne contient que 7 électrons,
encore un et c'est le paradis: H rêve de 2 électrons dans sa
dernière couche. Les deux atomes se disposent assez proche l'un de
l'autre pour que l'électrons de H soit si voisin de Cl qu'il puisse
être considéré comme logeant dans la demi case quantique
3p du chlore. Inversement, l'électron qui appartenait à Cl
se trouvera assez proche de H pour qu'il puisse aussi être considéré
comme logeant dans la case quantique 1s de H.
Ainsi, une liaison covalente est créée et la molécule obtenue est HCl. Le chlorure d'hydrogène.
E) Cl ne peut se lier que par une liaison covalente. H aussi: ce sont deux éléments "MONOVALENTS". Les colonnes 1 et 17 du tabeau périodique contiennent les éléments monovalents. Selon Lewis, les doublets de la couche de valence de l'oxygène et de l'hydrogène apparaissent ainsi:
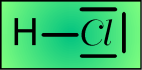
On lit UNE laison covalente (le tiret dirigé entre les atomes) et trois doublets non partagés (les barres atour de Cl). Dans le modèle L.C.A.O. il s'agit des cases quantiques 3s , 3px et 3py du chlore qui n'ont aucune raison de participer à la liaison.
C) Cette loi permet de savoir, à l'avance, combien de liaisons covalentes l'atome va contracter.
Quel ions monoatomique il pourra donner.
Est-ce qu'il pourra contracter une liaison de coordinence...
Cette règle de l'octet est très performante, mais elle a des limites..
