En général, pour étudier une liaison entre deux atomes, on choisit deux fonctions Y, une du premier atome et une du second. On trouve toujours deux solutions qu'on appelle "orbitales moléculaires"
Exemple: Y1 est l'orbitale atomique de l'atome 1. Y2, celle de l'atome 2.
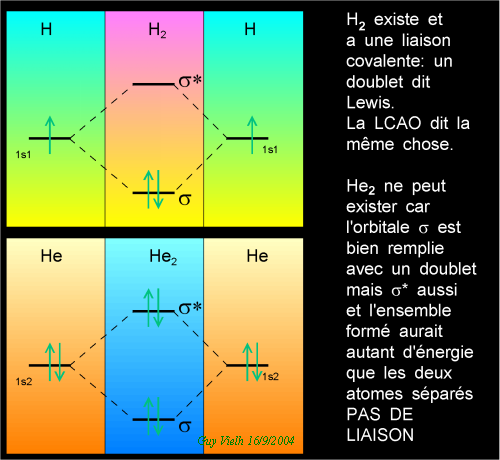
La première orbitale moléculaire est
.......... s = a1.Y1 + a2.Y2
si les deux atomes sont identiques, alors .............. a1 = a2
la deuxième est s* = a1.Y1 - a2.Y2.
En terme d'énergie s est plus basse que s*. Les électrons se placeront de préférence dans s.
s est l'orbitale moléculaire liante, et s* l'orbitale moléculaire antiliante.

L'équation de Schrödinger pour une molécule est intordable dans tous les cas où il y a plus de trois objets. Donc, à part l'atome H, He+ et H2+ les difficultés mathématiques sont insurmontables.
Ce qui est irritant car les cas intéressants: on ne sait pas les traiter.
L'astuce et le système D ont été sollicités.
Astuce: pour chaque atome, on a des solutions soit par la voie royale, la résolutions de l'équation de Schrödinger.
Soit par bricolage: les approximations .
Y1 , Y2 , Y3 ... sont les fonctions d'onde trouvées.
On démontre mathématiquement (astuce) que : . . a1.Y1 + a2. Y.2 + a3 .Y3 est aussi une solution. On choisit les coeff ai pour obtenir une nouvelle fonction dont le carré doit coller à la réalité (bricolage).