L'équation de Schrödinger:
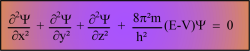
E = énergie totale de l'électron.
V = énergie potentielle de l'électron.
L'équation de Schrödinger:
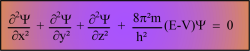
E = énergie totale de l'électron.
V = énergie potentielle de l'électron.
m = masse de l'électron ............................. h = constante de Planck ..=............ ............ h = (6,626176.10-34 J.s)
On ne sait résoudre exactement cette terrible équation que lorsqu'il n' y a qu'un seul électron: H , He+ , Li2+.
L'équation n'a de solutions que pour certaines valeurs de E. (ce sont les niveaux d'énergie)
En = 1/n² .(m.e4/8.e².h²)
on reconnaît en n le numéro de la couche électronique; le premier nombre quantique. Au cours de la résolution de l'équation apparaissent aussi les nombres l et m respectivement deuxième et troisième nombre quantiques.
Un électron est décrit par sa fonction d'onde Y qui n'est pas accessible à la mesure. Mais son carré Y² donne la probabilité de présence au point considéré.
On obtient les fonctions Y car elles sont les solutions de l'équation différentielle de Schrödinger.