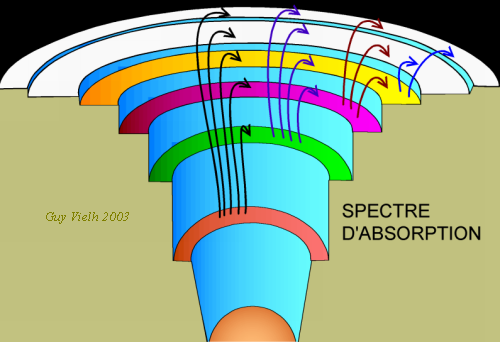
Il y en a si peu dans la direction de la lumière transmise, que cet emplacement reste sombre dans le spectre de la lumière qui a traversé le milieu absorbant.
Ces niveaux existent dans l'espace virtuel de l'énergie. Topologiquement ( dans l'espace géométrique) à quoi ressemblent les différentes zones qui contiennent les électrons des "couches"?
On les nomme "orbitales": visitez.
Il y en a si peu dans la direction de la lumière transmise, que cet emplacement reste sombre dans le spectre de la lumière qui a traversé le milieu absorbant.
... La
différence d'énergie entre deux niveaux de la transition est
DE . Selon Planck, la longueur d'onde de la lumière
qui apporte cette énergie est :
La
différence d'énergie entre deux niveaux de la transition est
DE . Selon Planck, la longueur d'onde de la lumière
qui apporte cette énergie est :
l
= h . c / DE. Les longueurs d'onde absorbées
servent à faire monter les électrons dans des niveaux supérieurs.
Ces longueurs d'onde manquent dans le spectre de la lumière transmise:![]()
Les électrons, autour de l'atome sont disposées en niveaux d'énergie. Lorsqu'un "photon" apporte EXACTEMENT l'énergie nécessaire pour faire changer un électron de niveau d'énergie, celui-ci saute dans ce niveau plus élevé. Il absorbe l'énergie du photon qui disparaît. Puis il redescend en rendant l'énergie, il y a émission en même temps mais
Les raies sombres sont la trace de l'absorption de certains photons qui ont fait "monter" des électrons sur les niveaux plus élevés.
Pour les atomes ou ions à l'état gazeux: ils sont "isolés" les uns des autres: les niveaux sont "purs" les raies sont fines. Voir les exemples.