

dm=Na x 63 x (-8,5).106.1,6.10-19/c²
dm = - 0,57 g/mol
soit 0,9% de la masse
Lorsqu'il s'agit d'un nucléïde, le nombre A est entier et il indique le nombre de nucléons présents dans le noyau: Z + neutrons = A
Le cuivre 63 a donc 29 protons et 34 neutrons.
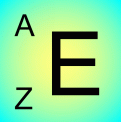
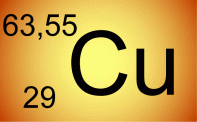 Élément
cuivre naturel
Élément
cuivre naturel
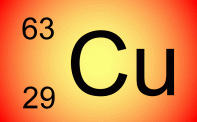
 deux
nucléïdes de l'élément
cuivre, ils sont isotopes. Il y a d'autres nucléïdes du cuivre.
Certains radioactifs que l'on ne trouve plus dans la nature car ils ont subi
une cascade de désintégrations, changeant la nature de l'élément
jusqu'à ce qu'ils donnent des nucléïdes stables.
deux
nucléïdes de l'élément
cuivre, ils sont isotopes. Il y a d'autres nucléïdes du cuivre.
Certains radioactifs que l'on ne trouve plus dans la nature car ils ont subi
une cascade de désintégrations, changeant la nature de l'élément
jusqu'à ce qu'ils donnent des nucléïdes stables.
On note toujours soit l'élément, soit le nucléïde de la même façon: dessins sur fond vert:
Z est le nombre de protons = numéro atomique.
A a deux acceptions. La masse d'une mole en grammes ou le nombre de nucléons dans le noyau.
Lorsqu'il s'agit de l'élément naturel: pour le cuivre 63,55 c'est la masse d'une mole de cuivre extrait d'un minerai. La masse n'est pas entière pour deux raisons:
* Mélange des isotopes 63 et 65
** Une partie de la masse a "disparu" dans les énergies de liaisons entre nucléons lors de la formation du noyau de chaque atome présent. Environ -8,5 MeV par nucléon.
Pour une mole de cuivre 63 , le "défaut de masse" dm est de: