....... l'atome avec son noyau dont la taille est exagérée
...............
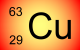

............................................................................ deux isotopes du cuivre
Le nombre de neutron n'a pas d'influence sur les propriétés chimiques. Comme la masse dépend du nombre total de particules présentes dans le noyau (les nucléons) c'est ce nombre que l'on donne.
A = nombre de masse
On symbolise l'élément par une lettre ou un groupe de deux lettres dont la première est une majuscule, la seconde minuscule.
On indique les nombres A et Z comme cela est montré dans la fiche nombre A
Deux atomes qui ont le même Z mais des nombres de neutrons différents sont ISOTOPES.
Ils ont mêmes propriétés chimiques, et occupent la même case du tableau périodique.
....... l'atome avec son noyau dont la taille est exagérée
...............
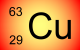

............................................................................ deux isotopes du cuivre
Découvert par Ernest Rutherford, le noyau de l'atome est extrêmement petit.
Typiquement il est de l'ordre de 10-15m soit le femtomètre
Naturellement, un noyau de numéro atomique
fort est plus gros qu'un noyau d'He ou de C.
Dans le noyau on rencontre deux types de particules:
Les protons chargés positivement
les neutrons ne portant aucune charge
Le nombre de protons caractérise l'élément chimique. Il est désigné par la lettre
Z
Les éléments sont classées d'une façon astucieuse dans le tableau périodique dit