
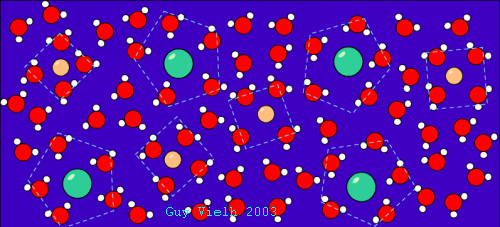
Dans un liquide il n'y a pas d'organisation à grande échelle. Tout au plus peut-on reconnaître localement de petites structures.
Dans l'illustration à droite, un soluté ionique est solvaté par des molécules d'eau. Lorsque le solvant est fortement associé en raison de forces intermoléculaires (ici liaisons hydrogènes) le liquide a tendance à la microorganisation locale.
Même l'eau pure continue à posséder de petits domaines où l'organisation de la glace est maintenue. L'agitation thermique démolit sans relâche ces associations qui se reforment différemment.
Près du point de solidification, évidemment, le nombre et l'étendue des domaines organisés est forte. Par contre, près du point d'ébullition, l'organisation est presque inexistante.
Les forces d'attraction entre les molécules sont responsables de l'existentce de l'état liquide:
