h = constante de Planck : 6,626176.10-34 J.s-1 n = fréquence de la lumière émise Hz
h = constante de Planck : 6,626176.10-34 J.s-1 n = fréquence de la lumière émise Hz
L'électron capturé peut suivre plusieurs chemins pour gagner la case libre. Parceque nous avons beaucoup d'atomes dans l'échantillon, toutes les raies sont produites.
Certaines transitions ne se produisent jamais: on dit qu'elles sont interdites.
Certaines, comme on peut le constater sur les schémas, sortent du domaine visible: l'appareil doit pourvoir les mesurer.
Un cas particulier est la fluorescence et phosphorescence.
...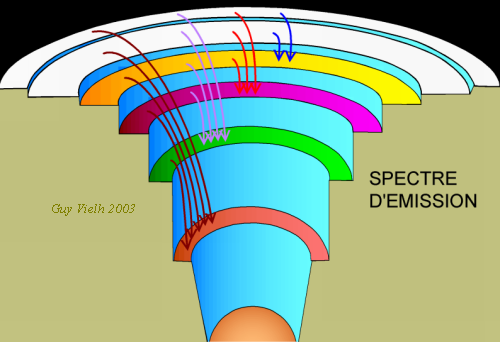
On représente les niveaux d'énergie comme les gradins d'un amphithéâtre. Le niveau rouge est la couche K, c'est la plus profonde, ce sont les meilleures places ... On doit avoir des séries de raies. Chaque chute est l'émission d'une longueur d'onde selon la formule de Planck. Plus la chute est grande, plus la longueur d'onde est courte. La série "noire" aura ses raies les plus énergétiques dans le domaine Ultra Violet. ........................... Revenir à spectre du sodium
Les électrons, autour de l'atome sont disposées en niveaux d'énergie. Si le gaz est sous faible pression (les atomes sont éloignés les uns des autres) les niveaux sont fins.
Si par un procédé quelconque (chauffage, décharge électrique, photons UV ou X) on a réussi à faire grimper ou même décamper un
Chaque marche correspond à une différence d'énergie (dE) : elle est émise sous forme d'un photon.
L'énergie de ce photon est en relation avec la couleur de la lumière émise par la relation de PLANCK :
dE = h .n . avec