......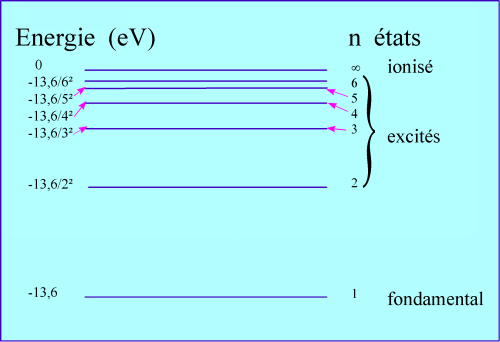
Les énergies sont portées en électron-volt (eV) car c'est une unité adaptée à l'atome, les nombres sont à notre échelle!( 1eV = 1,6.10-19J).
En = 1/n² .(m.e4/8.e².h²)
On reconnaît en n le numéro de la couche électronique: le premier nombre quantique.
Par le calcul, on obtient les niveaux et on constate qu'ils ne sont pas régulièrement espacés: 1/n² n'est pas une proportionnalité !
Sait-on vérifier la pertinence de ces calculs. OUI. Lorsqu'on apporte de l'énergie, l'électron peut l'absorber si elle correspond à un saut sur un niveau supérieur. C'est ainsi que les spectres d'absorption de la lumière confirment avec précision l'existence et la valeur des niveaux d'énergie.
Pour les autres atomes, la présence de plusieurs électrons fait apparaître que chaque niveau est structuré: deux nouveaux nombres quantiques (l et m) font leur entrée. Lorsque l'atome n'est plus isolé, les niveaux s'élargissent. Dans un solide, on a des niveaux qui sont des bandes d'énergie.
......
Les énergies sont portées en électron-volt (eV) car c'est une unité adaptée à l'atome, les nombres sont à notre échelle!( 1eV = 1,6.10-19J).
Un électron est décrit par sa fonction d'onde Y qui n'est pas accessible à la mesure. Mais son carré Y² donne la probabilité de présence de cet électron au point considéré.
On obtient les fonctions Y car elles sont les solutions de l'équation différentielle de Schrödinger.
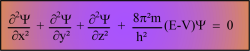
E = énergie totale de l'électron.
V = énergie potentielle de l'électron.
m = masse de l'électron ........................................ h = constante de Planck ..=. (6,626176.10-34 J.s) On ne sait résoudre exactement cette terrible équation que lorsqu'il n' y a qu'un seul électron: H , He+ , Li2+.
L'équation n'a de solutions que pour certaines valeurs de E. (ce sont les niveaux d'énergie)